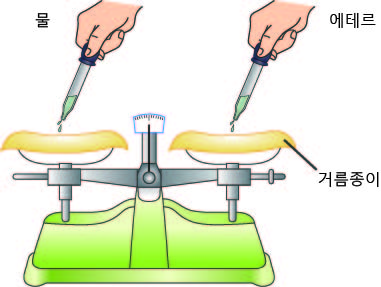
2오른쪽 그림은 25℃에서 밀폐된 강철 용기에 산소 기체를 넣었을 때의 입자 모습을 나타낸 것이다.

5그림과 같이 부피가 각각 2L와 4L인 플라스크 A와 B가 콕으로 연결되어 있고, 각각 산소 기체와 질소 기체가 들어 있다. 콕을 연 후 플라스크 내부에서 일어나는 일에 대한 설명으로 옳은 것만을 <보기>에서 모두 고르시오. (단, 온도는 일정하고, 질소와 산소는 반응하지 않으며, 분자 하나당 질량은 질소보다 산소가 크다.)

< 보 기 >
ㄱ. 콕을 열면 산소는 B쪽으로 이동한다.
ㄴ. 콕을 열어도 질소는 A쪽으로 이동할 수 없다.
ㄷ. 충분한 시간이 흐르면 산소가 차지하는 공간과 질소가 차지하는 공간이 같아진다.

6비커에 양초를 녹여 액체 상태로 만들었다가 식히면 (가) 그림과 같이 가운데가 오목하게 되면서 부피가 줄어든다. 고체와 액체 상태에 대한 분자모형 (나)를 이용하여 양초의 가운데가 오목하게 들어가는 이유에 대해 설명하시오.

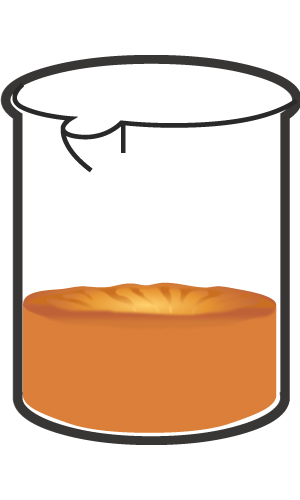
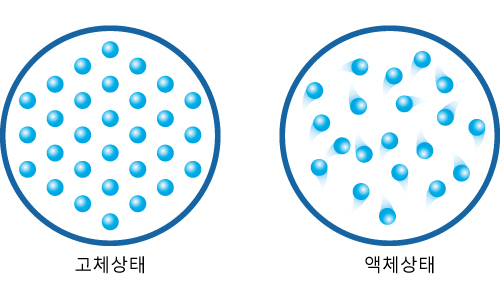
(가) (나)



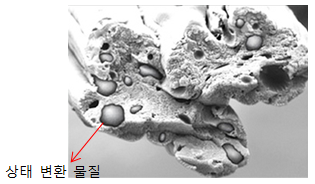
7그림 (가)와 같이 공기를 뺀 비닐 주머니에 액체 아세톤을 조금 넣고 입구를 막은 후, 비닐 주머니에 뜨거운 물을 부었더니 액체 아세톤이 사라지면서 그림 (나)와 같이 변했다.

이 때, 비닐 주머니 내부에서 일어나는 현상으로 적절한 것을 <보기>에서 모두 고르시오.
< 보 기 >
ㄱ. 전체 질량은 (가)보다 (나)가 더 크다.
ㄴ. 아세톤 분자 수는 (가)보다 (나)가 더 많다.
ㄷ. 분자들 사이의 거리는 (가)보다 (나)가 더 멀다.
ㄹ. 분자들의 움직임은 (가)보다 (나)가 더 활발하다.

※[8-9] 그림은 숨을 들이마실 때와 내쉴 때를 나타낸 것이다.
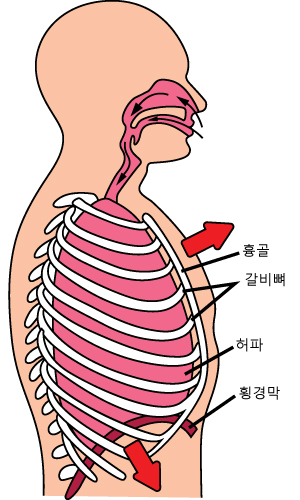
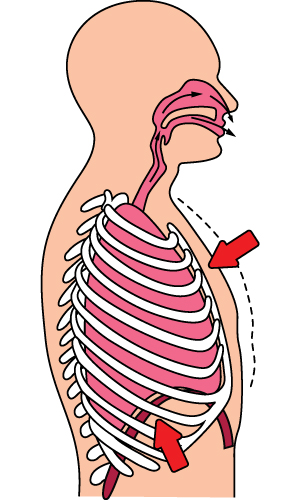
숨을 들이 마심 숨을 내쉼


8숨을 들이 마시고 내쉬는 원리에 대한 설명을 완성하시오.
공기는 기압이 높은 곳에서 낮은 곳으로 이동한다. 숨을 들이쉴 때 횡격막은 아래로 내려가고, 갈비뼈가 위로 올라가서 흉강의 부피가 (증가, 감소)하므로 흉강 내부의 압력이 몸 밖보다 (높, 낮)아져 공기가 폐로 들어오게 된다. 반대로 숨을 내쉴 때는 횡격막이 위로 올라가고, 늑골이 아래로 내려가서 흉강의 부피가 (증가, 감소)하므로 흉강 내부의 압력이 몸 밖보다 (높, 낮)아져 공기가 몸 밖으로 나가게 된다.
※수심 2m이상에서는 수면과 연결된 관을 이용해 숨을 쉬는 것이 아주 어렵다.
9아래 제시된 내용을 바탕으로 수심 2m에서 가슴을 누르는 물의 질량을 계산하시오.
∙ 물은 부피 1㎤당 질량이 1g이다.
∙ 가슴의 면적은 1000㎠ 라고 가정한다.
10수심 2m이상에서 수면과 연결된 관을 이용해 숨을 쉬는 것이 아주 어려운 이유를 8번과 9-(1) 번을 활용하여 설명하시오.
11그림은 1기압에서 어떤 기체의 온도에 따른 부피의 변화를 알아보는 실험을 통하여 얻은 결과를 나타낸 것이다.

위 그래프에 대한 설명으로 옳은 것만을 <보기>에서 모두 고르시오.
< 보 기 >
ㄱ. OA와 OB의 거리는 동일하다.
ㄴ. 실험을 2기압에서 진행하면 그래프의 기울기가 감소한다.
ㄷ. 기체의 분자 수를 증가시켜서 실험하면 A값은 더 작아진다.